

干扰素基因刺激蛋白STING(Stimulator of Interferon Gene)是锚定在内质网上感受外源DNA入侵的重要衔接蛋白,通过靶向STING激活cGAS-STING信号通路诱导抗肿瘤天然免疫,已成为继PD-1/PD-L1等免疫检查点抑制剂之后的免疫治疗“未来之星”。 STING与其配体cGAMP的结合可促进STING二聚或寡聚,进而募集丝氨酸/苏氨酸蛋白激酶(TBK1),磷酸化干扰素调节转录因子IRF3,诱导I型干扰素(IFN)及诸多促炎细胞因子的产生,最终激活细胞毒CD8 T细胞来促进适应性免疫应答。当前,STING调节剂已成为针对癌症及自身免疫性疾病等多种疾病的重要免疫治疗新策略,但STING作为药物靶标的成药性及其相关调节剂研究目前面临困境和挑战。
近日,8188www威尼斯张翱课题组及其在中科院上海药物研究所的研究组对cGAS-STING信号通路中具有重要生物功能的关键蛋白(cGAS、STING、TBK1、ENPP1)的成药前景、研究进展及存在的挑战进行了系统的总结,并提出了发展方向以及亟须解决的关键科学问题。
随后,课题组与上海药物研究所抗肿瘤药理研究团队紧密合作,基于已报道的氨基苯并咪唑二聚体类STING激动剂具有独特结构和高亲和力,但具有潜在毒性等特点,通过对该类化合物的几个热点结构位点(hotspots))进行了系统的渐进式结构优化,得到了新型三唑类衍生物。该类化合物对STING信号通路具有较强的激活能力,而敲除STING则活性丧失。新化合物能同时激活人源和鼠源STING,且对多种人源STING蛋白突变体均有激活作用,适用性广,活性强度较为理想。该化合物药代动力学性质较好,其水溶性比Nature杂志报道的氨基苯并咪唑二聚体STING激动剂高20倍以上。在免疫健全的小鼠乳腺癌和结肠癌肿瘤模型中,该三唑化合物的瘤内注射和静脉给药均具有显着的抗肿瘤效应,耐受性也较好,有一定的转化前景。
这些工作最近先后发表在国际知名学术期刊Acta Pharm Sin B(2020, 10, 2272-2298.)以及J Med Chem (2021, 64, 1649-1669.)。论文的第一作者分别是张翱课题组研究员丁春勇、联培博士生宋子兰以及上海药物所抗肿瘤药理研究团队研究人员王玺渊和张燕,通讯作者分别为张翱教授和谢作权副研究员。该工作受到上海交通大学“双一流”学科建设项目、重点前瞻布局基金以及中科院个性化药物先导专项和国家科技重大专项“新药创制专项”等项目的支持。
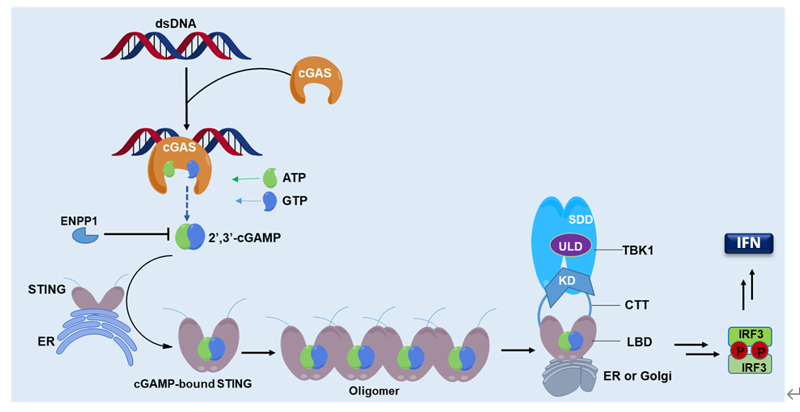
Figure 1. The cGAS‒STING‒TBK1 signaling pathway (Acta Pharm Sin B 2020).
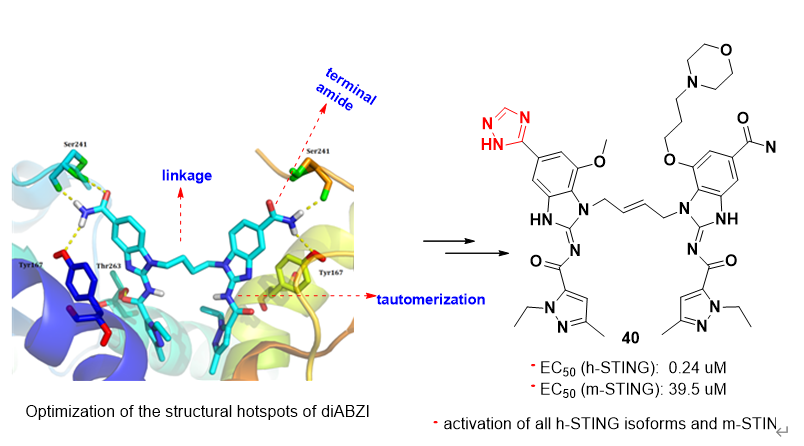
Figure 2. Design of new STING agonists by hotspots elaboration of Amidobenzimidazole framework (J Med Chem 2021).
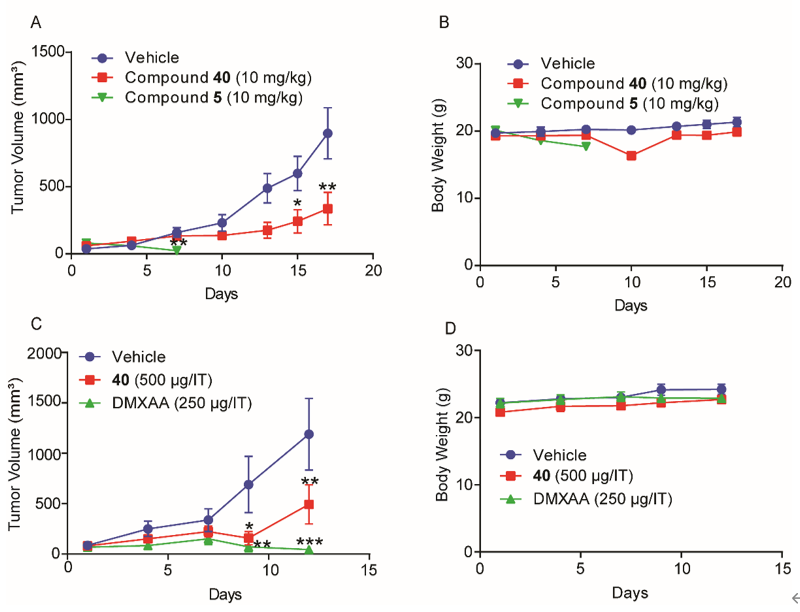
Figure 3. In vivo anti-tumor effects of new agonist 40 (J Med Chem 2021).
文章链接:
(1)https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7745059/pdf/main.pdf
(2)https://pubs.acs.org/doi/10.1021/acs.jmedchem.0c01900