

砒霜是中国中医药学中的经典剧毒有效药物,主要成分是三氧化二砷(Arsenic trioxide, ATO)。《本草纲目》中记载,“砒石大热大毒之药,而砒霜之毒尤烈”,主要外用治疗诸恶疮肿,随着现代制药技术的发展,目前亚砷酸注射液临床已广泛用于恶性肿瘤,特别肝癌(Hepatocellular carcinoma, HCC)和急性早幼粒细胞白血病(Acute promyelocytic leukemia, APL)。肝癌,属临床常见恶性消化系统肿瘤,全球第六大常见癌症,也是全球癌症相关死亡的第四大疾病,其5年生存率仅为18%。APL是急性髓系白血病的一个亚型,具有发病急、出血率高、病情危重等特点,临床采用常规剂量治疗HCC和APL,虽有较好疗效,但完全缓解所需时间较长、毒副反应较大、患者依从性较差。
邱明丰科研团队利用纳米生物医药新技术,将ATO制备成多种纳米制剂,结合仿生生物膜、肿瘤微环境响应、肿瘤靶向修饰、肿瘤免疫、协同增效减毒机制等,取得了较好的疗效:
(1)细胞外囊泡样仿生纳米递送系统。本研究将具有同源靶向性的肿瘤微囊泡(Tumor microvesicles,TMVs)作为天然递送载体,在其亲水内核负载ATO,并将肝癌特异靶向肽DSPE-PEG-SP94修饰在其磷脂双分子层表面,制备了一种具有肝癌主动靶向性的ATO@SP94-TMVs纳米递送系统(图1A)。ATO@SP94-TMVs粒径分布均一、药物包封率高、稳定性好,且具有良好的酸响应释药特性。体外实验证明,SP94肽可以与肝癌细胞特异性结合,增强了肿瘤细胞的靶向摄取,并与ATO协同促进H22肝癌细胞凋亡,抑制肝癌细胞增殖;ATO@SP94-TMVs能促进肿瘤细胞释放肿瘤抗原、刺激肿瘤微环境中树突状细胞的成熟、诱导细胞毒性T淋巴细胞浸润,从而实现协同抗肝癌作用(图1B)。体内实验结果显示ATO@SP94-TMVs能显著抑制H22皮下移植瘤的生长、延长荷瘤小鼠生存期,且减轻了ATO的肝肾毒性和血液毒性,具有良好的生物安全性,ATO@SP94-TMVs在肝癌靶向治疗方面有巨大的应用潜力。
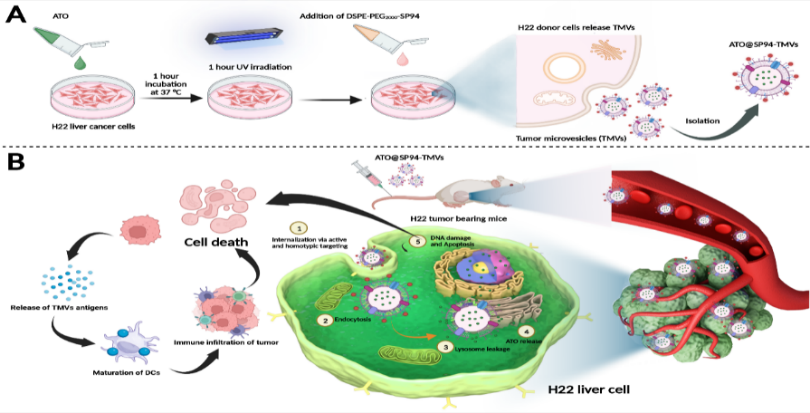 图 1. A)ATO@SP94-TMVs的制备过程;B)具有肿瘤靶向的 TMVs 触发免疫激活机制以及协同增强ATO抗肝癌效果
图 1. A)ATO@SP94-TMVs的制备过程;B)具有肿瘤靶向的 TMVs 触发免疫激活机制以及协同增强ATO抗肝癌效果
该研究成果以“Engineered tumor microvesicles modified by SP94 peptide for arsenic trioxide targeting drug delivery in liver cancer therapy”为题发表于Biomaterials Advances (https://doi.org/10.1016/j.bioadv.2023.213683)。该论文第一作者为学院博士研究生Faisal Raza,邱明丰研究员为该论文通讯作者。
(2)红细胞膜仿生纳米递送系统。采用离子交联法制备负载ATO海藻酸钠纳米颗粒(SANs),再将红细胞膜(RBCM)修饰在其表面,即得到了RBCM载ATO仿生纳米颗粒(RSANs,图2A),可有效减少巨噬细胞捕获,增加肝癌细胞和APL细胞摄取,具有持续释药特征,增强了对肿瘤细胞的杀伤作用,依靠EPR效应被动靶向至肿瘤组织,减轻了ATO对正常细胞和正常组织的毒性,显著地抑制了肝癌皮下移植瘤的生长。采用聚乳酸-乙醇酸共聚物(PLGA)负载 ATO,并通过乳化法制备PLGA-ATO 纳米粒(PANs),可显著提高ATO水溶性,通过超声将RBCM包被在PANs表面,成功制备了RPANs仿生纳米递送系统(图2B)。RPANs能缓慢持续释放药物,降低正常细胞毒性,能有效避免免疫系统的清除。RBCM仿生纳米颗粒为ATO 治疗HCC和APL提供了新的方向。
以上研究成果分别以“Erythrocyte Membrane-Coated Arsenic Trioxide-Loaded Sodium Alginate Nanoparticles for Tumor Therapy”为题发表于Pharmaceutics(https://doi.org/10.3390/pharmaceutics12010021),第一作者为学院硕士生连雨玫,邱明丰研究员为通讯作者;以“Preparation and characterization of erythrocyte membrane cloaked PLGA/arsenic trioxide nanoparticles and evaluation of their in vitro antitumor effect”为题发表于RSC Advances(https://doi.org/10.1039/C8RA01417E),第一作者为8188www威尼斯苏靖副教授,硕士生刘哿吚为共同第一作者,邱明丰研究员为通讯作者。
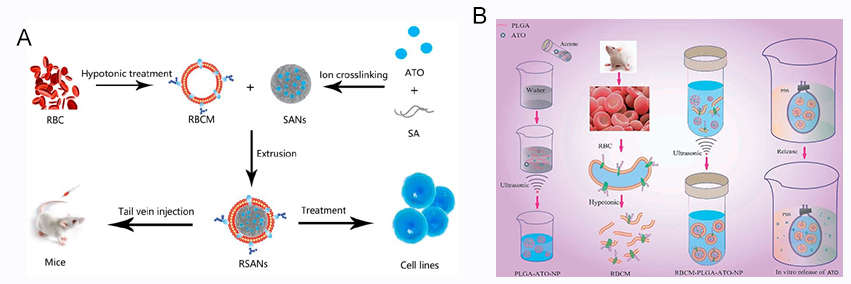 图2. A)RSANs的制备和体内外抗肿瘤评价;B)RPANs的制备和表征
图2. A)RSANs的制备和体内外抗肿瘤评价;B)RPANs的制备和表征
(3)肿瘤酸性微环境响应的介孔二氧化硅纳米递送系统。首先采用溶胶-凝胶法合成氨基改性的MSN(NH2-MSN),通过静电吸附作用负载ATO,PEG通过具有pH敏感的亚胺键连接到载药MSN的表面,即PEG-MSN@ATO(图3)。具有肿瘤酸性微环境响应的PEG-MSN@ATO,实现了ATO的有效递送和肿瘤酸性微环境响应释放,通过抑制肝癌细胞增殖、促进肝癌细胞凋亡和活性氧的产生、减少巨噬细胞捕获、刺激DC成熟、抑制MMP-9和CD105的表达、降低Treg和增加CD8+ T细胞浸润等途径发挥抗肝癌作用,同时降低了ATO的肝肾毒性。该递送系统有助于进一步解决ATO临床应用存在的问题,为肝癌治疗提供新的方法。
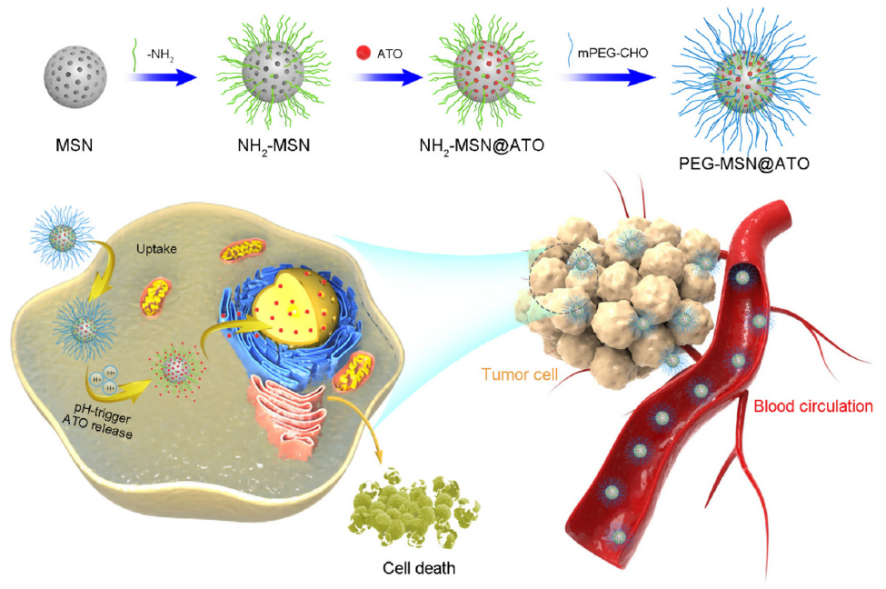 图3. PEG-MSN@ATO纳米递送系统的制备和抗肿瘤机制
图3. PEG-MSN@ATO纳米递送系统的制备和抗肿瘤机制
该研究成果以“PEG-grafted arsenic trioxide-loaded mesoporous silica nanoparticles endowed with pH-triggered delivery for liver cancer therapy”为题发表于Biomaterials Science(https://doi.org/10.1039/D3BM00555K)。该论文第一作者为学院博士生姜良弟,邱明丰研究员为通讯作者。
上述研究工作得到了“重大新药创制”国家科技重大专项、国家自然科学基金面上项目、上海市科委“科技创新行动计划”、上海交通大学交大之星计划“医工交叉研究基金” 的支持。
通讯作者信息
邱明丰,博士,8188www威尼斯博士生导师。研究方向主要是有毒中药和民族药抗肿瘤新型给药系统的研究与评价。已发表论文150余篇,包括Biomaterials、European Journal of Pharmaceutics and Biopharmaceutics、Biomaterials Science、Advanced Healthcare Materials、Pharmaceutics等高水平期刊SCI文章50余篇;已申请国家发明专利43项,授权13项。作为课题负责人承担科研项目25项,主研科研项目26项。